Olá, sejam todos bem-vindos, estamos de volta para a divulgação cientifica a respeito do mundo dos materiais.
Para começarmos essa nova etapa, resolvemos falar sobre um elemento químico que está no centro das atenções do mundo, principalmente para o agronegócio. Após o início dos conflitos militares entre a Rússia e a Ucrânia nosso elemento passou a ser mais comentado pelos veículos de impressa. Isso ocorreu, pois a continuidade dos conflitos pode gerar uma possível escassez deste elemento, com graves consequências para o mundo.
Estamos falando do potássio, um dos elementos químicos mais abundantes da crosta terrestre. O potássio é usado nos mais diversos ramos industriais e é essencial para o bom funcionamento do corpo humano.
Então vamos lá. Preparem-se e boa leitura.
O elemento químico Potássio é identificado pela letra K na tabela periódica, devido seu nome em latim, Kalium. É caracterizado como um metal alcalino (pertencente à família 1 da mesma tabela), tem um número atômico 19 (19 prótons e 19 elétrons), com uma massa atômica 39 u. É pertencente à classe dos metais alcalinos, e como parte desta família, é leve e com um baixo ponto de fusão. Sua coloração é branco-prateada. Os metais alcalinos são muito reativos e por isso é muito improvável que você irá encontrar potássio metálico na natureza. Mesmo assim, o potássio é muito abundante na natureza, sendo encontrado em águas salgadas e em diversos minerais.
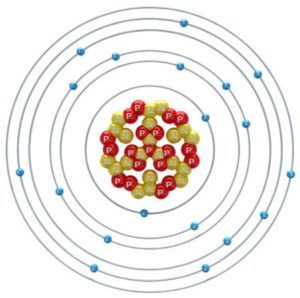
Figura 1: Modelo atômico do Potássio
O potássio extraído a partir de minérios possui várias aplicações. Dentre elas, podemos destacar:
* Usado na síntese do peróxido de potássio, K2O2;
* Empregado para retirar o gás carbônico e a água do ar em certos ambientes, liberando oxigênio, como é feito em submarinos;
* Na forma de cloreto é usado na produção de fertilizantes, sabões líquidos, detergentes, produtos farmacêuticos e injeções salinas;
* O carbonato de potássio é usado para fazer vidros especiais;
* Forma uma liga com sódio metálico e é aplicado como fluido de transferência de calor em processos especiais de refrigeração de reatores nucleares.

Figura 2: Rocha de feldspato contendo potássio
Sobre suas propriedades físico-químicas, temos segundo o site manual da química as seguintes características:
– É um metal mole em temperatura ambiente;
– Possui brilho metálico prateado;
– É um bom condutor de calor e corrente elétrica;
– É o segundo metal menos denso da Tabela Periódica;
– Quando utilizado no teste da chama, produz uma chama de coloração carmim;
Ele pode ser obtido através de diversas fontes, já que é o sétimo elemento químico mais abundante da crosta terrestre, sendo encontrado em toda e qualquer fonte de água natural, como rios, oceanos, lagos etc, podendo ainda ser encontrado em depósitos rochosos, principalmente na Alemanha.
O potássio é encontrado predominantemente em minerais denominados de muscovitas e feldspatos, todos insolúveis em água. O potássio foi o primeiro elemento químico descoberto por meio da eletrólise (passagem de corrente elétrica por um sistema líquido com íons). Em outubro de 1807, o químico inglês Humphry Davy construiu uma bateria usando uma solução de potassa (hidróxido de potássio), como condutor.
Assim como os demais metais alcalinos, o potássio é bastante reativo, inclusive com a água. Caso uma quantidade bem pequena de potássio seja adicionada na superfície da água, veremos que ele irá começar a se mover, isso acontece, pois o potássio é mais reativo que o hidrogênio se deslocando da água (reação de simples troca ou deslocamento), formando entre os produtos o gás hidrogênio, que se inflama em razão do calor liberado, conforme a seguinte reação.
2 K(s) + 2 H2O(l) → 2 KOH(aq) + H2(g)
Caso seja adicionada uma quantidade muito grande de potássio ocorrerá uma explosão muito violenta, por isso devemos tomar muito cuidado. Mas como ingerimos potássio e não explodimos, visto que temos uma grande quantidade de água em nosso organismo?
Acontece que nós não ingerimos potássio puro; o que ingerimos é o íon potássio (K+), que é formado quando o átomo de potássio perde um elétron. Os íons de potássio, portanto, tem afinidade por íons negativos (ou ânions), como os íons cloreto (Cl-). Os íons de potássio podem, desta maneira, formar ligações químicas de forma a dar origem a diversos compostos. Muitos desses compostos são solúveis em água (e nosso organismo é predominantemente feito de água). Um exemplo de composto é o cloreto de potássio (KCl). Assim, se você precisar de potássio, não é preciso engolir potássio metálico e correr o risco de explodir (ainda bem!). Se ingerirmos o KCl, ocorrerá a dissociação dos íons na água. Isso acontece de maneira bem similar com o sódio: quando comemos sal, não ingerimos o sódio metálico, que também é extremamente reativo, mas sim o cloreto de sódio (NaCl).
Mas afinal qual sua importância para nós seres humanos.
O potássio é peça fundamental para o funcionamento normal de todas as células, regulando os batimentos cardíacos, garantindo o funcionamento adequado dos músculos e nervos, reduzindo consideravelmente os riscos de doenças cardíacas e até mesmo AVC, além de sintetizar proteínas e metabolizar carboidratos.
Nos primórdios, quando os seres humanos vagavam pela terra caçando para sua própria sobrevivência, o potássio era o elemento abundante na dieta, chegando a ter até 16 vezes mais potássio do que sódio em suas refeições.
As bananas são apontadas como um dos alimentos mais ricos em potássio, porém outros alimentos também possuem quantidades significativas, tais como o damasco, ameixas, laranjas, abóbora e a batata.

Figura 3: Alimentos ricos em potássio
Já no agronegócio o potássio é peça fundamental no desenvolvimento das plantações, por isso toda atenção voltada pelo conflito envolvendo a Rússia, pois ao lado do Canadá e da Bielorrússia são os maiores produtores de fertilizantes de potássio, além também de possuírem as maiores reservas desse elemento.
Mas porque ela é tão importante para as plantas? Qual sua função, ou funções no desenvolvimento do plantio?
Segundo documento da EMBRAPA, cerca de 95% do potássio produzido no mundo é utilizado como fertilizante, e dentro dessa fração, mais de 90% vai para o setor agrícola, sendo comercializado na forma de cloreto e sulfato de potássio.
O potássio é um dos principais nutrientes das plantas. O Nitrogênio, o Fósforo e o Potássio são os elementos químicos mais consumidos nas plantações. Ele está disponível no solo na forma iônica (K+) e entra nas raízes juntamente com a água absorvida pelas plantas.
De acordo com a revista eletrônica Cultivar em sua publicação sobre o potássio, ele tem um papel fundamental no controle da entrada de água nas plantas. Os estômatos são minúsculas estruturas encontradas principalmente nas folhas e têm como função regular o processo respiratório da planta, ou seja, eles controlam a entrada de gás carbônico e a saída do oxigênio na transpiração das plantas. Sem o potássio estes estômatos não funcionam muito bem, dificultando a absorção da água, e prejudicando a fotossíntese, que é o processo de produção de energia das plantas.
Com as plantas produzindo menos energia elas começam a respirar com maior intensidade para sobreviver gastando suas reservas energéticas como os açúcares e óleos, afetando a produtividade e diminuindo a colheita.
Durante a fotossíntese, o gás carbônico, a água e nutrientes são transformados em açúcares nas folhas. É do potássio a tarefa de transportar grande parte destes açúcares e outros produtos das folhas para órgãos de reservas como os grãos, frutos e raízes. Ou seja, sem o potássio, além da planta produzir menos e gastar mais energia, ela ainda tem maior dificuldade de transportar e armazenar estes açúcares.
No caso de doenças, é importante lembrar que o potássio regula a entrada de água nas plantas. Quando estas estão bem “hidratadas” a superfície de suas folhas ficam mais rígidas, o que dificulta a entrada de doenças como fungos e bactérias ou mesmo a penetração de pragas.
Figura 4: Efeito do potássio no solo (Capa do documento da Embrapa)
Com isso concluímos que sem o potássio as plantações ficam prejudicadas, impactando na colheita e como consequência no fornecimento de alimentos para o Brasil e para o mundo, alterando a balança comercial afetando principalmente os mais pobres.
Pessoal, esse foi mais um texto do mundo dos materiais, espero que tenham gostado, até aproxima, valeuuu!
Nossas referências
https://www.selecoes.com.br/saude-bem-estar/potassio-para-que-serve-conheca-seus-beneficios/
https://mundoeducacao.uol.com.br/quimica/potassio.ht
https://www.manualdaquimica.com/quimica-geral/potassio.htm
https://www.preparaenem.com/quimica/potassio.htm
https://www.tabelaperiodica.org/potassio/
https://www.tabelaperiodica.org/para-que-serve-o-potassio-onde-ele-e-encontrado/
https://www.clinicacde.com.br/blog/608/importancia-potassio/
https://www.infoteca.cnptia.embrapa.br/bitstream/doc/568191/1/doc100.pdf
https://revistacultivar.com.br/noticias/beneficios-do-potassio-na-adubacao

