Olá, para todos, sejam bem-vindos ao mundo dos materiais!
No texto dessa semana vamos falar sobre a liga metálica mais usada no mundo, ultrapassando a produção de 1 bilhão de toneladas em um único ano, indispensável nos mais variados setores industriais e no nosso cotidiano. Estamos falando do aço, que muitos acabam chamando de ferro. Mas qual a diferença entre ferro e o aço? Existe de fato essa diferença? Prepare-se, o texto da semana está apenas começando.
Para falar do aço e suas propriedades, precisamos entender como ele é formado, e quais elementos o constitui, ou seja, como ele é produzido.
O material principal na produção do aço é o elemento químico ferro (Fe). O ferro (Fe) é o quarto elemento mais abundante da crosta terrestre, com cerca de 5% em massa, sendo o segundo metal mais abundante da terra ficando atrás apenas do alumínio
O ferro é um metal maleável, tenaz, com uma coloração branco-acinzentada, sendo um material sólido e ferromagnético à temperatura ambiente. O ferro (Fe) não é encontrado na sua forma metálica isolada na natureza, mas na forma de óxidos ou hidróxidos misturados com diferentes minérios. Os principais minérios com grandes quantidades de ferro são:
Hematita (Fe2O3); Magnetita (Fe3O4); Siderita (FeCO3); Limonita (Fe2O3.H2O); Pirita (FeS2). Os países com as maiores jazidas de minérios de ferro são: Austrália, Rússia, Brasil, China e Índia.
Outras propriedades do ferro são:
- Ponto de fusão: 1.538 °C
- Ponto de ebulição: 2.861 °C
- Estado físico a 20 ºC: sólido
- Densidade: 7,874 g/cm³
- Estados de oxidação: +2, +3, +4, +6
- Distribuição eletrônica: [Ar]3d64s2
- Isótopos naturais: 56Fe (mais estável), 54Fe, 57Fe e 58Fe
O principal uso do ferro é como matéria-prima para produção do aço, sendo a principal liga metálica desse elemento e para onde é destinado 98% do metal extraído da natureza. Mas antes precisamos falar sobre o outro material fundamental na concepção do aço, que é o carbono.
O elemento químico Carbono (C) é um não-metal do 2º período do grupo 14 (família do carbono) da Tabela Periódica. Seu número atômico é 6, ou seja, possui seis prótons em seu núcleo, com um peso atômico de 12,011 u. O carbono está presente em grande parte dos compostos orgânicos, inclusive nos seres humanos. Ele é o principal elemento da vida, podendo ser combinado com o oxigênio formando o gás carbônico (CO2), e diversas outras combinações.
O carbono tem uma propriedade química bem interessante que permite a formação de diferentes materiais a partir de sua construção estrutural. Essa propriedade recebe o nome de alotropia. Existem pelo menos sete alótropos do carbono: os mais conhecidos são a grafita (alfa e beta) e o diamante. Ainda existem os fulerenos e os nanotubos de carbono, materiais sintéticos feitos exclusivamente de carbono, sem contar o grafeno (temos um texto que falamos do grafeno acesse aqui).
Podemos encontrar o carbono em diferentes aplicações:
- Em combustíveis, como gasolina, diesel, gás natural e carvão;
- Na fabricação de lápis, eletrodos e lubrificantes (na forma de grafite);
- Na fabricação de joias e, por conta da sua dureza, em instrumentos industriais de corte, perfuração etc.;
- Na datação de objetos encontrados em sítios arqueológicos (como isótopo radioativo do carbono, C-14);
- E no nosso caso nas indústrias siderúrgicas para a produção do aço.
Depois de conhecer um pouco melhor os dois elementos químicos que formam o aço, está na hora de falar desse material que revolucionou nossa civilização moderna.
Para a produção do aço partimos da extração dos minérios de ferro, como por exemplo a hematita, obtendo este metal a partir das reações de oxirredução com o monóxido de carbono em altas temperaturas.
O percursor do aço recebe o nome de ferro-gusa sendo obtido a partir dos minérios: hematita (Fe2O3), magnetita (Fe3O4), limonita (2Fe2O3.3H2O) e siderita (FeCO3) juntamente com o carvão e o calcário.
A formação básica do ferro se dá a partir da interação dos minérios com o monóxido de carbono (CO) gerado pela combustão do carvão. O processo de transformação se dá em algumas etapas, começando pelo carregamento do minério de ferro, carvão e calcário (carbonato de cálcio) no alto-forno. A partir do aquecimento desse sistema ocorrem reações químicas que reduzem o ferro.
Inicialmente o carbono reage com o oxigênio formando o monóxido de carbono, que reduz o ferro à medida que as temperaturas vão se elevando. Porém esse metal não está 100% puro, possuindo ainda uma taxa de carbono elevada, que pode ser atenuada a partir de processos de purificação.
Na etapa de purificação obtemos o ferro metálico, mas como ele apresenta alta ductilidade e alto custo de produção, a quantidade de carbono passa a ser controlada para produzir o ferro gusa com um percentual de até 5% de carbono. Na imagem a seguir veremos um pouco mais a respeito dessas reações e suas respectivas temperaturas.
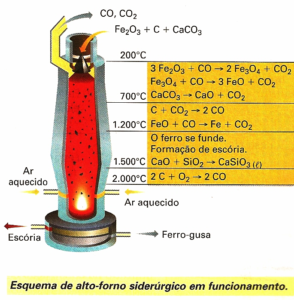
IFRS Tecnologia em Processos Metalúrgicos
Com isso podemos definir o aço como uma liga metálica composta por aproximadamente 98,5% de Fe (ferro), 0,5 a 1,7% de C (carbono) e traços de Si (silício), S (enxofre) e P (fósforo).
Após o processo de produção do ferro-gusa inicia-se a etapa de refino, ou seja, a produção dos aços e ferros fundidos que serão comercializados. Sobre os ferros fundidos, já falamos sobre ele em outro texto (caso queira saber sobre os ferros fundidos acesse aqui).
Mas os aços não são todos iguais. O que difere um aço do outro e porque suas propriedades são tão distintas?
Suas diferenças vêm principalmente da quantidade de carbono retirado no processo de purificação. Por definição o aço tem que possuir uma concentração de carbono abaixo de 2,11% em massa. Mas mesmo com essa quantidade tão baixa, o carbono altera consideravelmente as propriedades do material. A melhor maneira de visualizar essa variação de concentração de carbono e como isso interfere diretamente nas propriedades do aço é observando o gráfico de concentração de carbono vs temperatura. Esse gráfico é tão importante para quem estuda os materiais e suas diferentes concentrações que recebe um nome particular: é o diagrama de fases em equilíbrio. Com esse diagrama fica bem mais fácil para compreender as estruturas formadas e a influência da concentração dos elementos envolvidos e das temperaturas de processamento.
Uma parte do diagrama de fases do sistema ferro-carbono está mostrado na Figura abaixo:
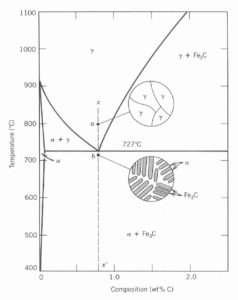
Figura 2: Diagrama de fases FeC
Nesse sistema os elementos tidos como impurezas são controlados para não interferir nas propriedades do aço. Então podemos dizer que o aço é simplesmente uma mistura de ferro mais carbono. Daí vem o nome sistema ferro-carbono.
Outra diferença é que esse gráfico mostra a concentração de carbono até 2,11% em peso. Isso nada mais é que um recorte do diagrama, deixando de lado o restante do gráfico, que apresenta as características dos ferros fundidos.
Analisando o diagrama ele começa com 100% ferro e 0% de carbono. Esse é o ferro metálico. Ao adicionar carbono no ferro metálico temos a produção dos aços, que podem ser classificados em aços de baixo carbono, aço médio carbono, e aços com alto carbono.
Os aços de baixo carbono normalmente contém 0,04% a 0,30% de carbono. São também chamados de aços doces; são aços extremamente dúcteis, moldáveis com muita facilidade, muito usados na indústria de estamparia.
Já os aços de médio carbono têm um teor de carbono de 0,31% a 0,60% e um teor de manganês variam de 0,060% a 1,65% em peso de carbono. Este material é mais resistente que o aço com baixo teor de carbono e é mais difícil de moldar, soldar e cortar.
Por fim os aços de alto carbono, também conhecidos como “aço carbono para ferramentas”, normalmente tem uma faixa de concentrações de carbono entre 0,61% e 1,50%. O aço com alto teor de carbono é muito difícil de cortar, dobrar e soldar. É o aço mais resistente, mas também o menos flexível.
Outra classificação dos aços a partir do diagrama de fases Fe-C, ocorre segundo a ocorrência da reação eutetóide. Os aços normalmente são classificados em quatro categorias: aços que não apresentam transformação eutetóide: ligas apresentando teores de carbono variando entre traços de carbono até 0,021% de carbono, em peso; aços hipoeutetóides: ligas apresentando teores de carbono variando entre 0,02 e 0,76% C, em peso; aço eutetóide: a liga que apresenta 0,76% C, em peso, ou seja, exatamente a composição química do ponto eutetóide; e aços hipereutetóides: ligas apresentando teores de carbono variando entre 0,76% e 2,14% C, em peso.
Essa pequena diferença na quantidade de carbono que é adicionada à liga muda completamente as propriedades mecânicas do aço (o modo de resfriamento também é chave fundamental nas mudanças das propriedades, mas isso será discutido em outro texto no qual falaremos de tratamentos térmicos).
A ideia é bem simples: imagine um pote com diversas bolas de sinuca. A medida que as bolas de sinuca se empilham, elas acabam criando vazios entre elas chamadas de interstícios. Se adicionarmos ao pote bolinhas menores, como bolas de gude, por exemplo, algumas serão capazes de preencher esses espaços vazios. Porém, à medida que as bolas de gude preenchem os espaços vazios, as bolas de sinuca vão ficando cada vez mais imóveis, até o momento que elas não conseguem se mexer mais. Em um determinado momento, fica impossível preencher os vazios com mais bolinhas de gude. Isso se deve a restrição do pote. Agora imagine que as bolas de sinuca representam os átomos de ferro, que são maiores do que os átomos de carbono, representados belas bolinhas de gude. Quanto mais carbono colocamos, menor será a mobilidade atômica do ferro, deixando o aço mais rígido, até o limite aceitável de 2,11%, após essa quantidade teremos a mudança de aço de alto carbono para o ferro fundido.
Com o aumento da quantidade de carbono no ferro, além do ganho de dureza, também aumentamos sua resistência ao desgaste, sua resistência à flexão, aumento na rigidez do material e outras alterações quando aliado a diferentes tipos de tratamentos térmicos. A ausência de carbono também é importante, principalmente na flexibilidade do material, na sua capacidade em absorver impactos e menores esforços na sua conformação. Podemos concluir que o aumento ou não da quantidade de carbono irá depender do tipo de propriedade que seu produto vai requerer. (temos um texto no qual tratamos das principais propriedades mecânicas dos materiais, acesse aqui e saiba mais).
Para finalizar nosso texto, veremos algumas das inúmeras aplicações que o aço é capaz de suprir.
- Utilidades domésticas
Empregado nos restaurantes, cozinhas industriais, hospitais, laboratórios, empresas em geral e nas casas das pessoas, tem a resistência necessária para os mais variados usos em forma de utensílios domésticos.
- Transporte
O aço está presente nos carros, caminhões, ônibus, trens, metrôs, navios, bicicletas e motocicletas.
- Construção civil
Concreto armado, concreto protendido, concreto pré-moldado, estruturas metálicas, fachadas, concretos com fibras metálicas, malhas para lajes entre outros.
- Energia
O aço é usado em hidrelétricas, termelétricas e nucleares, torres de transmissão, transformadores, cabos elétricos, plataformas, tubulações, equipamentos de prospecção e extração de petróleo, assim como em perfuratrizes, esteiras e caçambas das minas de carvão.
Após a leitura do texto concluímos que na maioria das vezes o que chamamos de ferro é na verdade aço, e que sim podemos usar o ferro metálico para algumas aplicações, porém bem raras, devido seu alto custo e suas propriedades.
Com isso finalizamos mais um material, espero que tenham gostado. Deixaremos algumas referências usadas nesta produção, mas existem uma vasta bibliografia sobre o tema. Um forte abraço e até o próximo material.
https://brasilescola.uol.com.br/
https://educacao.uol.com.br/https://materiaisjr.com.br/
https://www.totalmateria.com/

